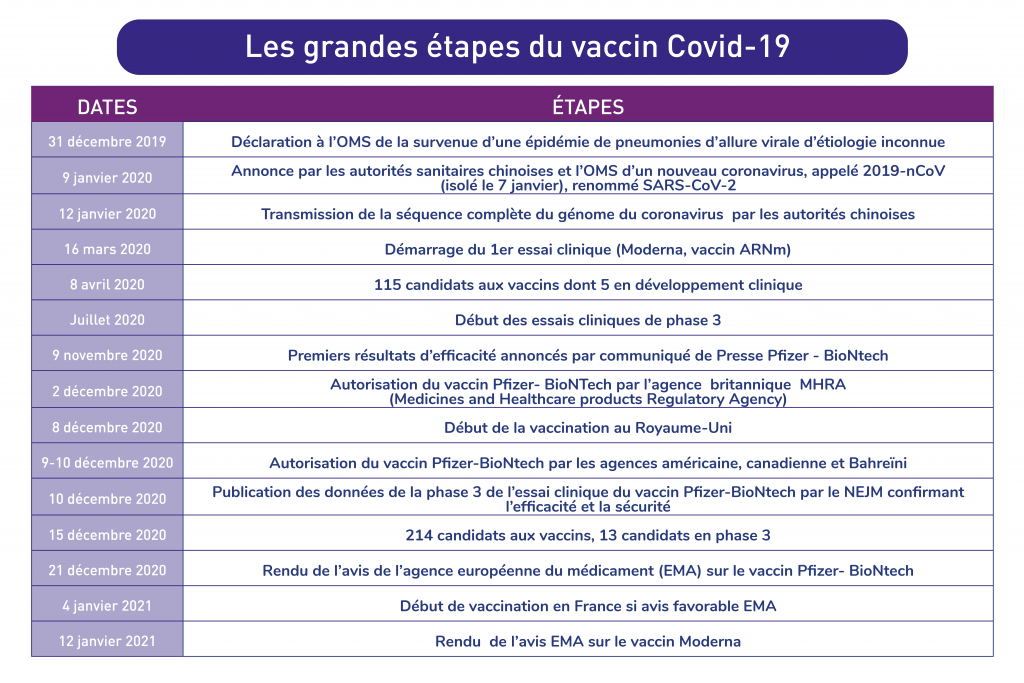
8 décembre 2019, la Covid-19 n’existait pas.
12 mois plus tard, plus de 73 millions de cas identifiés et 1,6 millions de décès, le monde occidental a les yeux rivés vers Margareth et son beau t-shirt bleu nous souhaitant un « Merry Christmas ». Margareth Keenan a 90 ans et elle est la première patiente anglaise à recevoir une injection du vaccin produit par l’alliance allemande-américaine Pfizer- BioNTech dans le cadre de la campagne de vaccination massive contre la Covid-19 lancée par le Royaume-Uni. Deux jours après cette première injection, les données de l’essai clinique de phase 3 de ce vaccin étaient publiées dans le NEJM, confirmant une très grande efficacité et un profil de sécurité rassurant.
Vaccin Pfizer-BioNTech, premières données publiées : efficacité et sécurité au rendez-vous
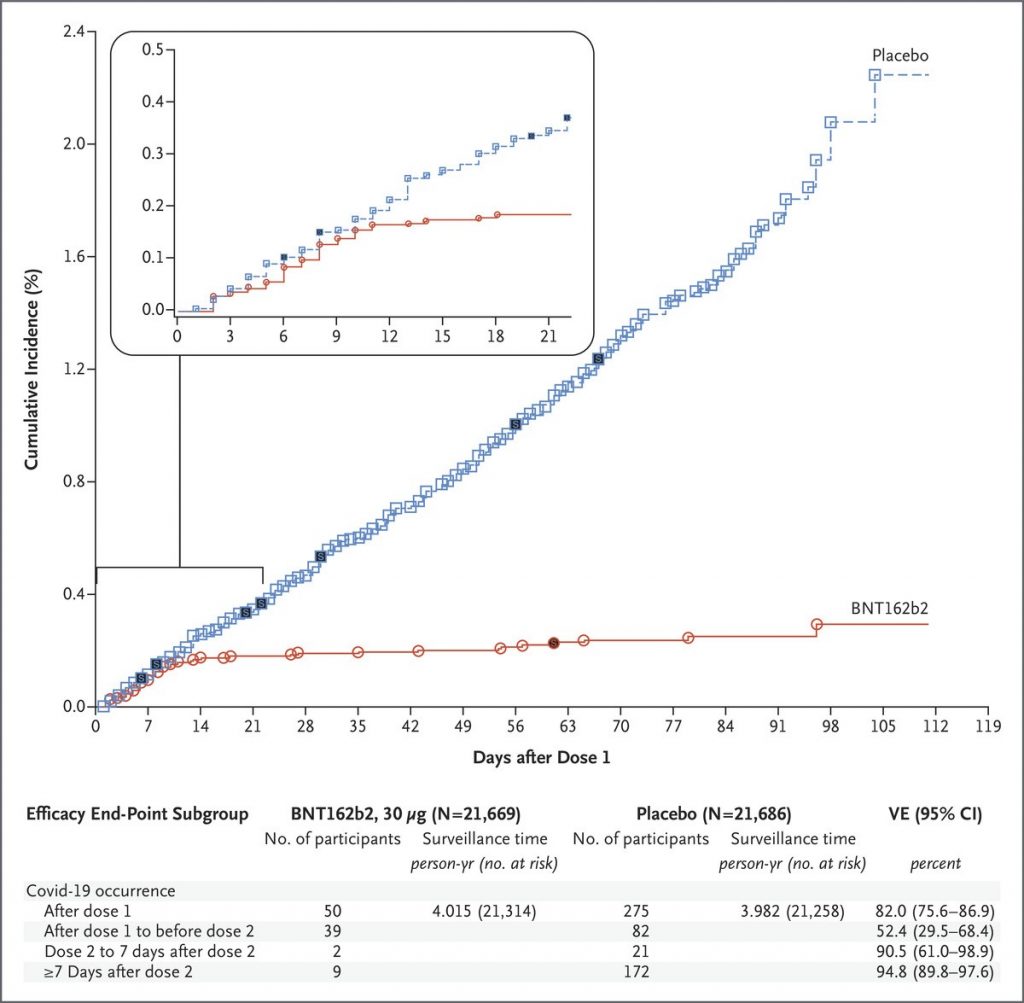
L’essai débuté fin juillet a inclus 43 448 participants de plus de 16 ans répartis en 2 groupes :
- un groupe vaccin recevant 2 doses de 30 microgrammes du vaccin (BNT162b2) à 21 jours d’écart,
- un groupe placebo recevant 2 doses d’une solution saline à 21 jours d’écart.
Les résultats confirment la très forte efficacité revendiquée dans les précédents communiqués de presse. Les personnes vaccinées avaient 95 % de risque en moins de contracter la Covid-19 (cf. figure) et l’efficacité était similaire quels que soient l’âge, le sexe, l’origine ethnique, le poids ou la présence de pathologies.
En termes de données de sécurité, les éléments rapportés sont rassurants avec des réactions locales au point d’injection, de la fatigue et des maux de tête fréquents comme observés avec la plupart des vaccins. Très peu d’effets indésirables graves ont été recensés (0,5 %) et leur proportion entre les 2 groupes vaccin et placebo était similaire. La phase 4 de l’essai dite de pharmacovigilance permettra de suivre d’éventuels effets indésirables non encore identifiés lors de la phase 3. Le Royaume-Uni, suite à la survenue de 2 cas de réaction importante au vaccin, a émis 48 heures après le début de sa campagne vaccinale la recommandation de ne pas vacciner les personnes « ayant un historique de réaction allergique importante à des vaccins, des médicaments ou de la nourriture (comme des réactions anaphylactiques ou ceux à qui il a été conseillé de porter un injecteur d’adrénaline) ».
Un début de vaccination en France prévu en janvier 2021
En France, nous sommes dans l’attente de l’autorisation de l’agence européenne du médicament (EMA) pour le recours en Europe aux vaccins développés par Pfizer-BioNTech et Moderna. Des verdicts attendus respectivement pour le 21 décembre 2020 et le 12 janvier 2021. La commission européenne a engagé 6 accords de préachat pour mettre près de 1,5 milliard de doses de vaccins anti-Covid-19 à la disposition des États membres, dont 200 millions pour la France assurant une marge de sécurité pour pallier aux autorisations qui ne seraient pas accordées ainsi qu’aux éventuelles pertes.
En cas d’avis favorable, la campagne de vaccination française pourra commencer à se déployer dès le 4 janvier pour le vaccin Pfizer-BioNTech. La HAS s’est positionnée fin novembre sur la stratégie à adopter et a défini un calendrier en 5 phases en prenant en compte la disponibilité des doses et les populations à cibler en priorité en raison de leur vulnérabilité (cf. figure).
Ainsi à l’aube de 2021, quand bien même des études complémentaires restent nécessaires, notamment pour préciser la durée de la protection et l’impact sur la transmission, nous avons toutes les cartes en main pour nous lancer dans cette campagne de vaccination. Il nous faudra maintenant la réussir. D’après l’enquête CoviPrev de Santé publique France, la proportion de personnes acceptant de se faire vacciner est passée de 64% en juillet à 53% en novembre. Le dernier document HAS du 15 décembre nous offre des pistes pour favoriser l’adhésion de la population avec comme mots d’ordre simplicité, transparence, non-obligation. On peut également citer cet article du JAMA sur les déterminants positifs. Tous les points sont importants mais le premier est crucial aux yeux des spécialistes du changement de comportement à savoir “Ne mettez aucun obstacle sur le chemin de ceux qui ont envie de se faire vacciner”. En effet, dans un pays à haut niveau de défiance, la dynamique peut se faire autour de ceux, et il y en a beaucoup, heureusement, qui sont persuadés du bienfondé de cette approche préventive. Ne ratons pas cette opportunité et suivons le conseil de Margareth à l’issue de son injection ‘”If I can have it at 90 then you can have it, too!” »
Margareth, yes we can ! Merry Christmas to you and everyone.
Points de débat dans les médias
Vaccin à ARNm
Si la presse s’est emparée du sujet récemment, la première publication expérimentale sur un vaccin à ARN messager (ARNm) date de 1993 et le premier essai chez l’homme de 2012. Les scientifiques depuis de nombreuses années se heurtaient à des obstacles techniques de transport de ces acides nucléiques jusqu’aux cellules en raison de leur taille supérieure à un antigène protéique injecté via un vaccin traditionnel. La solution a été trouvée récemment par les équipes des 2 candidats aux vaccins en attente d’un avis favorable de l’EMA (Pfizer-BioNTech et Moderna) en utilisant des particules nanolipidiques.
Cette nouvelle technologie de vaccin repose sur l’injection d’une molécule, un ARN messager (ARNm) qui va être traduit par nos cellules en protéine (protéine Spike) présente à la surface du SARS-CoV-2. En reconnaissant ces protéines “étrangères” mais inoffensives (puisque produites sans le reste du virus), l’organisme va déclencher une réponse immunitaire et produire des anticorps capables de neutraliser le SARS-CoV-2 s’il venait à nous infecter. Les réponses immunitaires suscitées par l’ARNm (ARN messager) sont similaires à celles d’une infection naturelle. Pour en savoir plus sur les vaccins à ARNm vous pouvez consulter l’article du Monde de Marc Gozlan “L’aventure scientifique des vaccins à ARN messager”, le Canal détox de l’INSERM et une courte vidéo pédagogique proposée par l’infectiologue Nathan Peiffer-Smadja et Julia Hamel.
La conservation
Le respect de la chaine du froid pour préserver l’efficacité du vaccin représentera effectivement un défi logistique important puisque pour celui de Pfizer-BioNTech produit en Belgique, le laboratoire recommande une conservation à – 80 degrés.
La semaine dernière, les modalités de stockage, conservation et préparation de ce vaccin ont été précisées aux établissements de santé par le ministère de la santé. Les vaccins Pfizer/BioNTech seront d’abord stockés à -80°C par les dépositaires pharmaceutiques et livrés en 24/48 heures dans toute la France aux officines ou pharmacie à usage intérieur des établissements de santé qui pourront le stocker, une fois décongelé à une température comprise entre 2°C et 8°C jusqu’à 5 jours avant de le livrer aux établissements accueillant des personnes âgées. Pour en savoir plus, consultez l’article de TechHopital.